ルイス構造式

まとめ シアン化水素・一酸化炭素の電子式・構造式は?窒素・酸素・水素の電子式・構造式は? 常温にて気体(ガス)の代表といえるである二酸化炭素・窒素・酸素・水素・シアン化水素・一酸化炭素の電子式と構造式について解説しました。 炭素原子とは少し異なりますが、窒素原子においても同じような混成軌道を形成します。

まとめ シアン化水素・一酸化炭素の電子式・構造式は?窒素・酸素・水素の電子式・構造式は? 常温にて気体(ガス)の代表といえるである二酸化炭素・窒素・酸素・水素・シアン化水素・一酸化炭素の電子式と構造式について解説しました。 炭素原子とは少し異なりますが、窒素原子においても同じような混成軌道を形成します。

このとき、まず1モルの気体の体積は常温常圧下で約22. これらの電子は,一定個数がグループをつくり,原子核のまわりをいくつかの軌道に分かれて運動しています。
8
この反応性の高さは、上述したようなビラジカル構造によるものです。 いくつかあるのですがお分かりになるものだけで結構ですのでお答えください。
3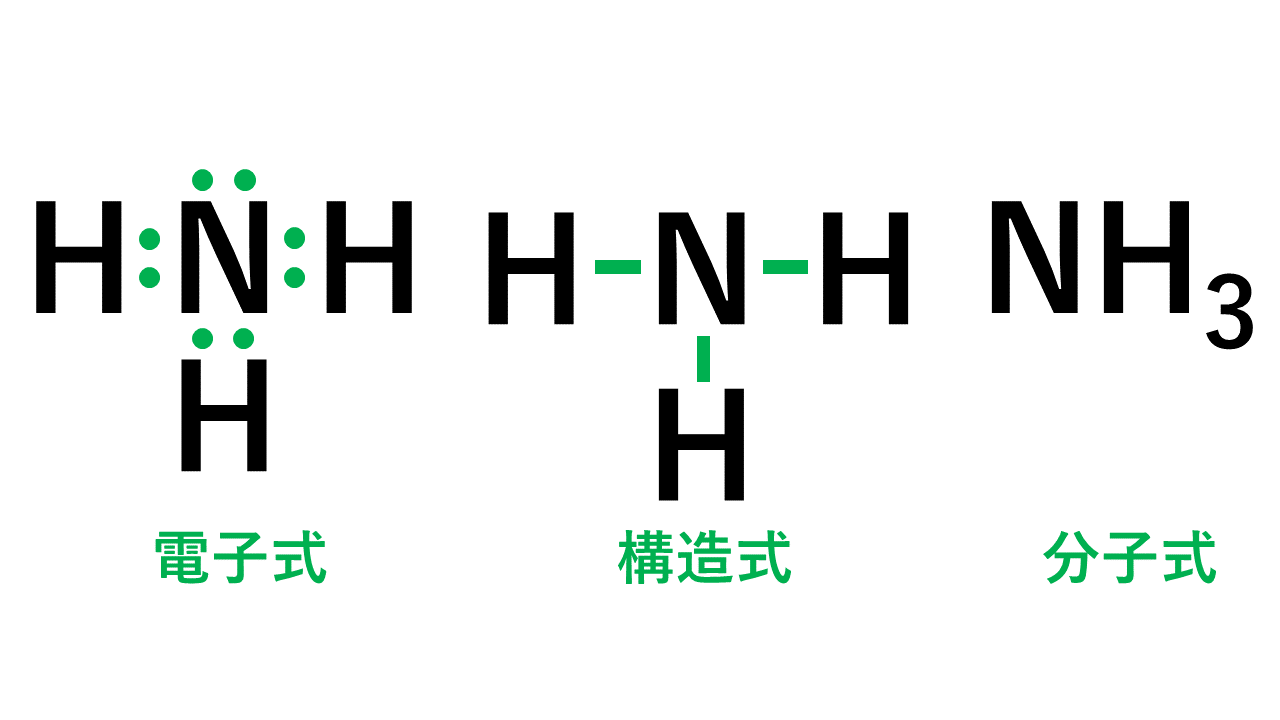
要するに、超共役というのは、単結合の切れたような構造を含む共鳴のようなものであり、その構造がカルボカチオンの正電荷を非局在化させ、安定化に寄与するということです。 ケクレ構造に加えて電子のドットを書き、どのように化学反応が起こっているのか記すのです。 すなわち、通常の共鳴においては、単結合が切れたような構造は考えませんが、超共役というのは、C-H結合の切れた構造を含む共鳴のようなものと考えればわかりやすいと思います。

しかし高温ではを発揮し、および有機物などは一酸化二窒素中で燃焼する。 これは炭素Cの最外殻電子が4個、酸素Oの最外殻電子が6個であることからこのようになるのがわかるでしょう。 A ベストアンサー なぜといわれるとかなり難しい話になります。
10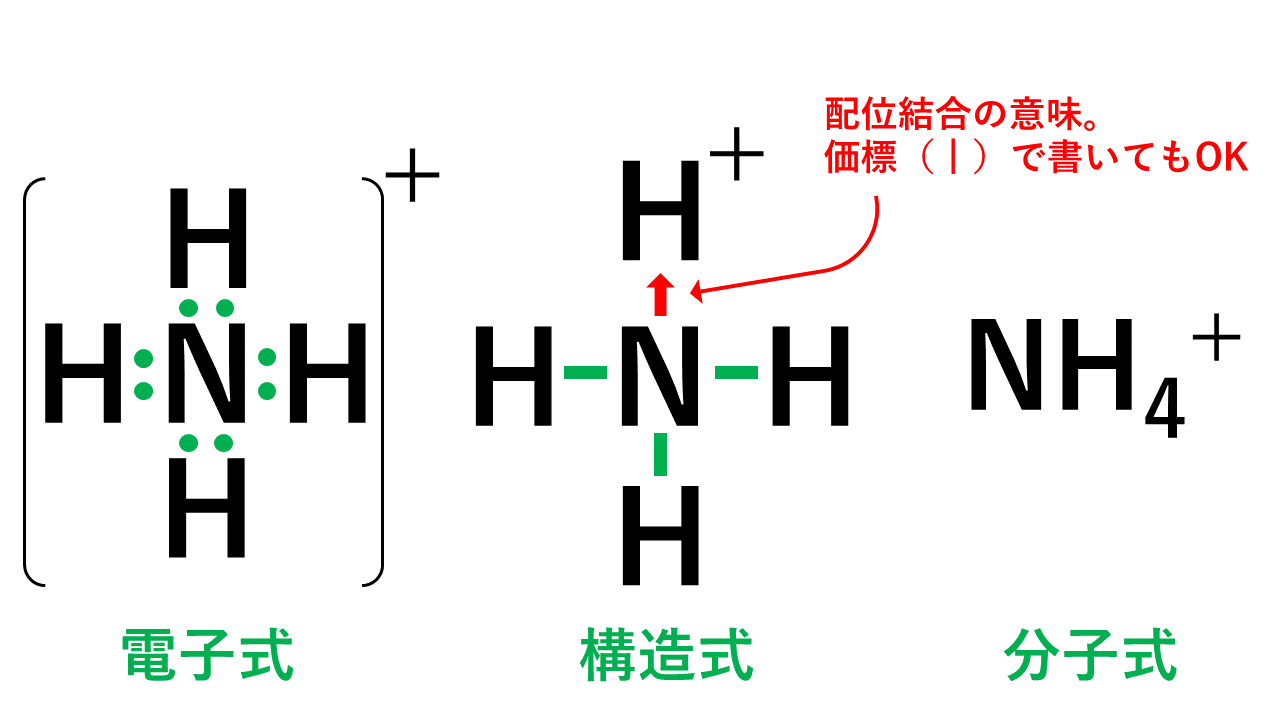
パウリの原理に従い、エネルギーの低い軌道から電子を詰めていくと、2つの原子はどちらも結合性軌道に位置します。
15