状態関数と経路関数 示量性状態関数と示強性状態関数とは?

出典 ブリタニカ国際大百科事典 小項目事典 ブリタニカ国際大百科事典 小項目事典について の解説. 本問で求めるのは放電に伴う標準ギブズエネルギー変化(kJ・mol-1)である。
7
出典 ブリタニカ国際大百科事典 小項目事典 ブリタニカ国際大百科事典 小項目事典について の解説. 本問で求めるのは放電に伴う標準ギブズエネルギー変化(kJ・mol-1)である。
7ここでの「1mol当たり」とは、全電池反応より、 「1molのCH3CHOが還元されるのに当たり」ということを意味する。 ・圧力 ・濃度 ・密度 ・(モルギブズエネルギー) ・温度 ・(標準酸化還元電位) 化学ポテンシャルはモル当たりのギブズエネルギーであり、示強性か示量性の変数を規格化したようなものと覚えておくといいです。
5しかし、化学反応はまずそれ以前の問題として『 活性錯合体』になることが必要です。

圧力変化によるギブズエネルギー変化 それではある圧力におけるギブズエネルギーを他の圧力での値からもとめてみましょう。 1ギブズエネルギーにも記載したように物質量n, 体積V, 内部エネルギーU, エントロピーS, エンタルピーH, ギブズエネルギーG, ヘルムホルツエネルギーA は示量性を持つ。 示強性状態関数 一方で示強性の状態関数は以下のものが挙げられます。
2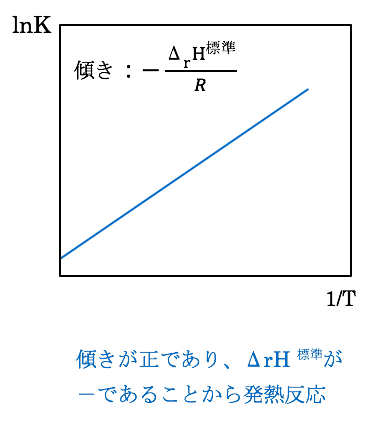
ところが実際には、反応が進むに従って反応物が減少して生成物が増加する物質量変化がある上に、反応の途中では反応物と生成物が混ざっているので混合によるエントロピー変化もある。 これらの量が物質の量が増えるとその値も変化します。 電気がする仕事は電力量で表される。
4
すべてが実測可能な状態量であることも重要なのだが、同じくらい重要なのは、温度 と圧力 を固定して議論するときにギブズエネルギーを使えば、3個ある変数のうち2個を外すことができるということである。 そのため、エンタルピー変化だけを考えると溶解は自発的に起こらない。
20